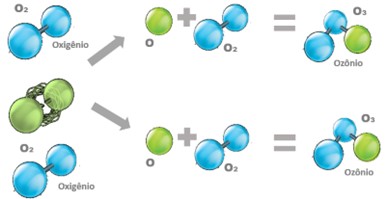
A Química do ozônio é conhecida pelo arranjo molecular triatômico e instável do oxigênio representado em sua forma molecular: “O3”. Em química, usamos a expressão “sintetizar” quando obtemos uma substância a partir de outra estrutura molecular. Sendo assim, “o ozônio não é formado e sim sintetizado”. Sua síntese acontece através da exposição do oxigênio de fórmula molecular “O2” a uma alta quantidade de energia capaz de romper as suas ligações moleculares promovendo a separação da molécula de oxigênio “O2” em oxigênio molecular “O”. O átomo livre de oxigênio “O” se une a uma outra molécula de oxigênio “O2” e sintetiza o ozônio “O3”.
Figura 1 – Como o ozônio é sintetizado
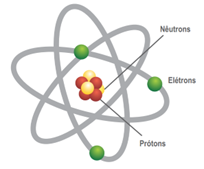
Para entender por que o ozônio é um potente oxidante, devemos primeiro compreender sua estrutura atômica. A estrutura de todo átomo é dividida em duas regiões:
- o núcleo: constituído por prótons (com carga positiva) e nêutrons (partículas neutras) e
- a eletrosfera: formada por elétrons (com carga negativa) que orbitam o núcleo.
Figura 2 – Estrutura de um átomo
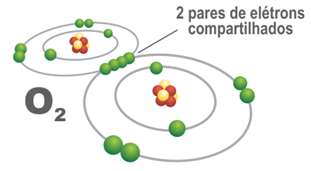
Ao analisarmos o oxigênio atômico, podemos verificar que ele possui: oito prótons, oito nêutrons e oito elétrons. O átomo de oxigênio tem seis elétrons na última camada, e, se combina com outro átomo de oxigênio por meio de ligação covalente dupla para formar a molécula de oxigênio (O2). Ao passar por um gerador de ozônio, o átomo de oxigênio recebe energia suficiente para romper suas ligações moleculares. A molécula de oxigênio (O2) perde elétrons e divide-se em dois átomos de oxigênio (2O). A representação eletrônica de Lewis ajuda a compreender o arranjo de elétrons na eletrosfera da molécula de oxigênio (O2).
Figura 3: Representação Eletrônica de Lewis
E, por que o ozônio é um poderoso oxidante? Devido ao fato dele ser formado por dois átomos estáveis e um terceiro muito instável. Com um núcleo “forte” (contendo 8 prótons) e uma quantidade de elétrons menor, o átomo instável procurará se ligar a outros elementos “mais fracos” (que possuem um núcleo com uma quantidade menor de prótons). O átomo instável retirará elétrons de outros elementos. Este processo é conhecido por “oxirredução”.
Em química, o termo “oxidação” foi inicialmente criado para denominar as reações nas quais o oxigênio era o reagente. As reações de oxidação ocorrem simultaneamente com as reações de redução. Por isso, essas reações são chamadas de “oxirredução” (ou redox), na qual existe a transferência de elétrons. Em reações de oxirredução, o agente oxidante é o que aceita os elétrons (o átomo de oxigênio instável da molécula do ozônio), sofrendo redução. O agente redutor perde os elétrons e sofre oxidação (o carbono ou outro elemento como por exemplo: ferro, manganês etc.).
Química do ozônio: Alotropia do oxigênio
O oxigênio é um elemento “alótropo”, ou seja, pode se arranjar em combinações de vários átomos iguais para formar substâncias diferentes. Cada substância possui uma quantidade diferente de átomos. As principais formas alotrópicas do oxigênio são:
- “átomo de oxigênio” ou “oxigênio livre” (O);
- “molécula de oxigênio” (O2) composta pela combinação de dois átomos e
- “molécula de ozônio” (O3), obtida por combinação de três átomos de oxigênio.
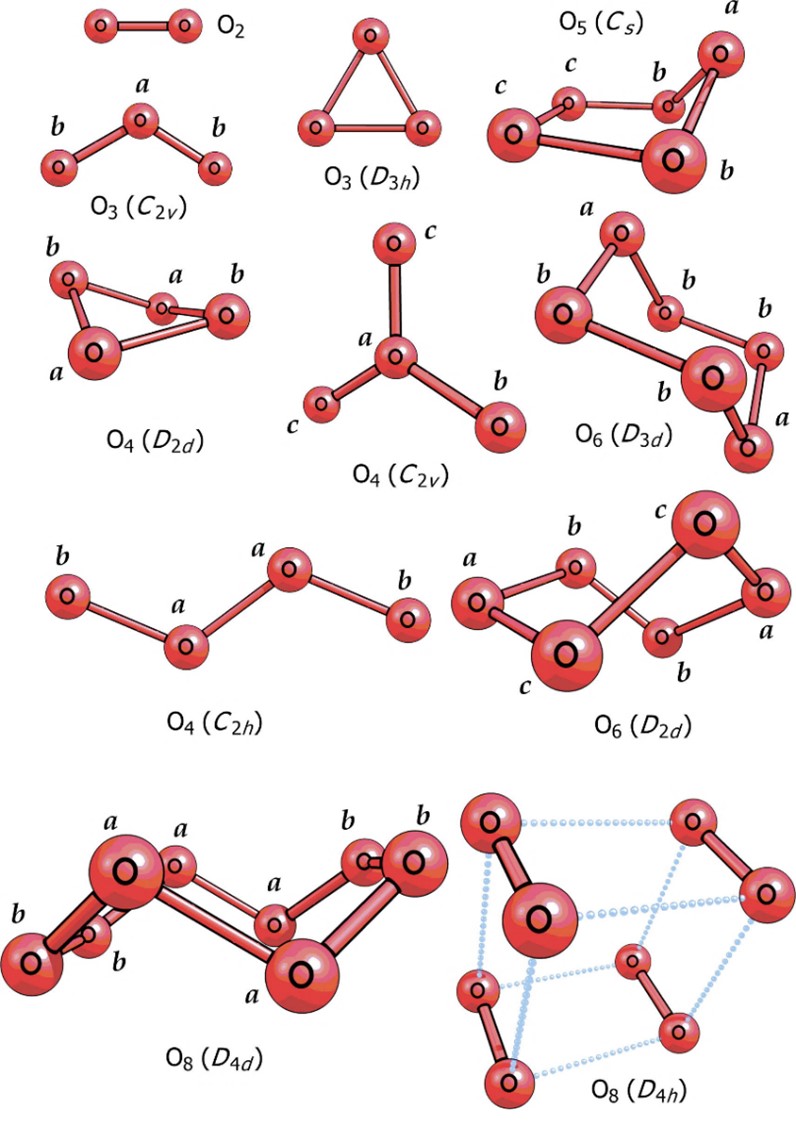
Segundo Sabirov et al., (2015) os átomos de oxigênio também podem se arranjar em moléculas pela combinação de quatro, cinco, seis e até oito átomos (O4, O5, O6, O8). Moléculas formadas por mais de três átomos de oxigênio são raras e grande instabilidade. O tetraoxigênio (O4) foi previsto inicialmente em 1924 por Gilbert N. Lewis, indicado para o Prêmio Nobel de 1922 a 1944. Suas descobertas foram revistas várias vezes, mas nem de longe desconsiderado.
Figura 4 – Alótropos de oxigênio molecular
As propriedades físico-químicas do ozônio
Ozônio gasoso
O ozônio é um gás de cor azul claro à temperatura ambiente quando gerado a partir do ar ambiente seco, mas incolor quando gerado a partir de oxigênio de alta pureza. Indepedentemente da tecnologia de produção. Em concentrações mais usuais para a maioria das aplicações industriais, sua cor azul não é perceptível.
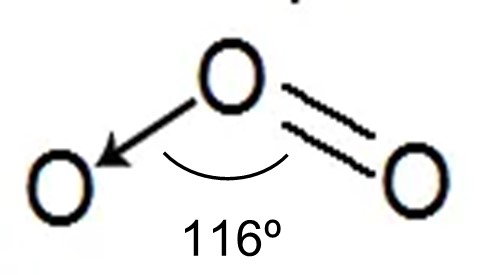
Os três átomos de oxigênio na molécula de ozônio são dispostos em um ângulo obtuso, pelo qual um átomo de oxigênio central é ligado a dois átomos de oxigênio equidistantes; o ângulo incluído é de aproximadamente 116° 49′ e o comprimento da ligação é de 1.278 Å.
Figura 5: Fórmula estrutural plana do ozônio
À temperatura ambiente, o ozônio é um gás instável. Segundo MANLEY & NIEGOWSKI (1967); KELLS et al., (2001), o ozônio se degrada facilmente em oxigênio. Mas tem uma meia-vida mais longa no estado gasoso do que na solução aquosa (Rice, 1986). O ponto de ebulição do ozônio é de -111,9 ± 0,3 °C, e o ponto de fusão é de -92,5 ± 0,4 °C, a temperatura crítica[1] é de -12,1 °C e a pressão crítica é de 54,6 atm (MANLEY & NIEGOWSKI, 1967). Apresenta-se na Tabela 2.2 algumas propriedades físico-químicas do gás ozônio.
Tabela 1 – Principais propriedades do ozônio gasoso
| Cor | Incolor a azulado, função da concentração |
| Cheiro | Odor pungente distinto irritante (detectado em concentrações superiores a 0,01ppm). E, desagradável (odor sulfuroso) acima de 2ppm |
| Massa molecular | 48 g.mol-1 |
| Ponto de fulgor | Não aplicável |
| Ponto de fusão | -111,3°C |
| Ponto de ebulição | -112 ºC |
| Temperatura crítica | -12,1°C |
| Densidade do gás | 2,14 kg.m-3 |
| Pressão de Vapor a 20 ºC | 1,974 (atm à 100ºC) |
| Coeficiente de difusão do ozônio no ar | 2,5 cm2s-1 |
| Viscosidade dinâmica do ozônio gasoso | 1,90 x 10-5 kg.m-1s-1 |
Ozônio solubilizado em água (água ozonizada)
O mecanismo de decomposição do ozônio na água não foi completamente resolvido, mas alguns cenários sugerem decomposição em radicais hidroxila, íons oxigênio e hidroperóxido. Em faixas de pH acima de 7,5 a formação de radicais hidroxila é aumentada (PEHKONEN, 2001). Os radicais livres de hidroxila têm um potencial de oxidação maior (2,80V) que o próprio ozônio (PEHKONEN, 2001).
A pureza e a composição química da água afetam a estabilidade do ozônio, isto se deve ao fato do ozônio poder reagir com os elementos presentes na água. Em água pura, o ozônio degrada-se mais lentamente em oxigênio, mas em soluções impuras ele se degrada de forma mais acelerada. São principalmente a matéria orgânica e metais presentes em água que consomem grande parte do ozônio solubilizado.
Aproximadamente 50% do ozônio solubilizado é destruído em 20 minutos a 20°C em água da torneira, enquanto apenas 10% do ozônio se decompõe em 85 minutos em água destilada a 20°C (HILL & RICE, 1982). Isto se deve ao fato de que, da água da torneira possui elementos químicos que reagem e “consomem o ozônio” mais rapidamente.
A temperatura também é uma variável que afeta a solubilidade do ozônio na água. O aumento da temperatura diminui a solubilidade do ozônio. A solubilidade do ozônio na água é 13 vezes maior do que a do oxigênio em temperatura ambiente de até 20 a 30°C. E, é progressivamente, mais solúvel em água mais fria (Rice, 1986). A 0°C, a solubilidade do ozônio é de 640 ml de ozônio/L de água, enquanto a temperatura de 60°C é insolúvel em água (HILL & RICE, 1982).
Tabela 2- Tempo de meia vida do ozônio em água
| Meia vida do ozônio dissolvido em água (pH 7) | ||
| Temperatura (F°) | Temperatura (C°) | Tempo (min) |
| 59 | 15 | 30 |
| 68 | 20 | 20 |
| 77 | 25 | 15 |
| 86 | 30 | 12 |
| 95 | 35 | 8 |
Fonte: “Ozone – A Reference Manual – Supplementary Swimming Pool Treatment” by Poolpakinternational.com MK2_PTL_OZONE_Rev-20110527.pdf (www.wqa.org)
As águas destiladas, bidestiladas e deionizadas conseguem prolongar o tempo de meia vida do ozônio dissolvido para algumas horas. Isto se deve pelo fato destas águas serem “puras” e livres de metais, matérias orgânicas e outros elementos que reagem com o ozônio dissolvido. Este tipo de água costuma ser utilizado para uso clínico (medicinal, estético e odontológico) ou algumas aplicações específicas industriais como produção de medicamentos e cosméticos pela indústria farmacêutica.
A água ozonizada de uso industrial (usada na higienização de alimentos, ambientes, equipamentos, etc.) utiliza geralmente uma fonte de água limpa usada no processo da indústria. É necessário sempre evitar o uso de água que contenha muito ferro e manganês para produção de água ozonizada. Mas vale lembrar que mesmo estas águas podem ser viabilizadas se previamente forem tratadas através de filtros abrandadores para retirar ferro e manganês, que são elementos oxidáveis, e poderiam consumir o ozônio e reduzir a qualidade da água ozonizada.
Este universo de variáveis que interferem diretamente na qualidade da água ozonizada pode ser resumido em:
- temperatura;
- pressão;
- ph;
- tempo de ozonização;
- características químicas da água;
- características do gerador de ozônio;
- características da fonte de oxigênio;
- tamanho, quantidade e concentração da bolha de gás utilizada durante a incorporação;
Tabela 3 – Propriedades do ozônio
| Propriedade | Ozônio | Oxigênio |
| Solubilidade em água (0°C) | 0,64 | 0,049 |
| Densidade (g/L) | 2,144 | 1,429 |
| Potencial eletroquímico (volts) | 2,07 | 1,23 |
temperatura crítica pode ser definida como aquela temperatura em que acima dela a substância pode existir somente na forma de gás. Acima desta temperatura a substância gasosa não pode ser condensada por compressão isotérmica (mantendo a temperatura igual e aumentando a pressão).

Vivaldo Mason Filho
Fundador e diretor da myOZONE. Vice-presidente da Abraozônio.
Administrador de Empresas e Especialista em Análise de Sistemas pela PUCCAMP, Especialista e Mestre em Engenharia.
Atuou por 11 anos como Professor Universitário nos cursos de graduação e pós-graduação de Administração, Comércio Exterior e Engenharia de Produção.

