A maioria das pessoas tem o conhecimento que o ozônio é um excelente oxidante. O que poucos sabem é porque ele funciona tão bem. Quimicamente, o ozônio é conhecido pelo arranjo molecular triatômico e instável do oxigênio conhecido em sua forma molecular (O3). Pode ser gerado por diversas tecnologias, e todas possuem um ponto em comum: a exposição do gás oxigênio em alta quantidade de energia conseguindo promover a dissociação das suas ligações moleculares, convertendo-o em seus átomos constituintes. Para a produção de ozônio, diversas tecnologias podem ser usadas:
- fotoquimicamente pela ação da radiação solar na estratosfera terrestre,
- em plantas de radiação gama,
- por lâmpadas de mercúrio que emitem radiação ultravioleta (UV) com comprimento de onda na faixa de 185nm,
- através da produção de arcos elétricos de alta tensão (corona ou plasma).
A medida que expomos as moléculas de oxigênio em uma das 4 tecnologias, o oxigênio perde elétrons e se rompe formando radicais atômicos de oxigênio. Estes por sua vez são muito ativos e se combinam com outras moléculas de oxigênio para produzir ozônio molecular: O3.
O oxigênio é um gás alótropo, em química, isso significa que o oxigênio forma substâncias diferentes agregando-se unicamente em quantidades de átomos diferentes. Ele costuma ser conhecido pelas suas três principais formas: o “átomo de oxigênio” ou “oxigênio livre” (O), a “molécula de oxigênio” (O2) composta pela combinação de dois átomos, e a “molécula de ozônio” (O3), obtida por combinação de três átomos de oxigênio.
Mas, o oxigênio também pode formar outras moléculas pela combinação de quatro, cinco, seis, sete e até oito átomos de oxigênio (O4, O5, O6, O7, O8). Estas outras moléculas formadas também somente por oxigênio são mais raras, difícil de ser medida e possuem capacidade de oxidação maior que o próprio ozônio (O3). Uma única molécula octatômica (O8) consegue oxidar seis vezes até voltar em seu estado natural, o oxigênio biatômico (O2).
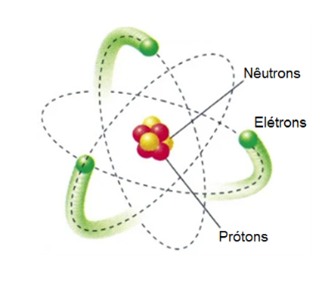
Para entender o porquê o ozônio é considerado um potente oxidante, deve-se primeiro compreender sua estrutura atômica. Todo átomo é dividido em duas regiões: o núcleo, que é formado por prótons e nêutrons, e a eletrosfera, formada por elétrons que orbitam o núcleo.
Estrutura de um átomo
Se olharmos a tabela periódica vemos que o oxigênio possui 8 elétrons, 8 prótons e 8 nêutrons, perdendo somente para o flúor que possui 9 elétrons, 9 prótons e 9 nêutrons.
Tabela Periódica
Em química e física, toda vez que você expõe um gás a uma grande quantidade de energia consegue-se promover a dissociação das suas ligações moleculares, convertendo-o em seus átomos constituintes.
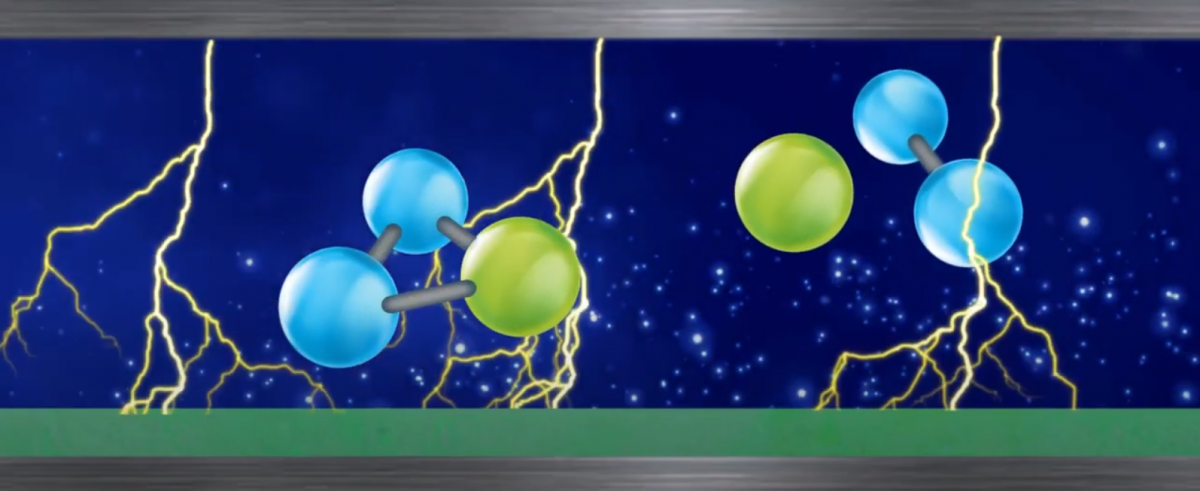
Ao romper suas ligações moleculares do oxigênio, existe uma perda de elétrons produzindo dois átomos radicais de oxigênio (possuem elétrons faltando), mas seu núcleo continua forte. Com elétrons a menos, o oxigênio atômico (O) se liga a uma molécula de oxigênio (O2) e forma o ozônio (O3).
A molécula de ozônio possui dois átomos estáveis com a mesma quantidade de prótons e elétrons e um terceiro muito instável com elétrons a menos. Os átomos estáveis possuem núcleo forte contendo 8 prótons e 8 elétrons. Já o átomo instável também possui um núcleo forte com 8 prótons e uma quantidade menor de elétrons.
Estrutura de um átomo
O átomo instável procurará oxidar, ou seja, ligando a outro elemento “retirando” elétrons destes outros elementos mais fracos formando o que conhecemos por oxidação que se resume em adicionar o oxigênio à outras substâncias.
A instabilidade do ozônio é o que o torna tão especial, oxidando elementos e voltando ao seu estado natural: o oxigênio.

Vivaldo Mason Filho é Administrador de Empresas e Especialista em Análise de Sistemas pela PUCCAMP, Especialista e Mestre em Engenharia pela USP. Empresário e especialista na implantação de ozônio para indústrias de alimentos. Atuou por 11 anos como Professor nos cursos de graduação e pós-graduação de Administração, Comércio Exterior e Engenharia de Produção. É atual vice-presidente da Associação Brasileira de Ozônio – ABRAOZÔNIO.