O ozônio na degradação de micotoxinas age na quebra das moléculas complexas das micotoxinas em moléculas menores e não tóxicas. O processo de degradação pode variar de acordo com a estrutura da micotoxina.
O controle da atividade de fungos em grãos é um grande desafio de produtores e empresas que produzem e comercializam alimentos. Isto se deve aos riscos da contaminação e deterioração acelerada e até perda do produto agrícola. Na grande maioria das vezes, o controle, se resume, em um processo de secagem do grão em manter uma umidade baixa o suficiente para evitar com que fungos presentes não produzam micotoxinas.
O ozônio pode contribuir não só com o controle e mortalidade dos fungos presentes em produtos agrícolas, mas também com a capacidade de degradar micotoxinas já criadas nestes fungos.
Um exemplo disso temos o café, que dependendo do tempo e condição em que foi armazenado, fungos presentes podem ter produzido toxinas que alteram características sensoriais no produto prejudicando o seu valor de comercialização no mercado gerando prejuízos.
A contaminação por micotoxinas impõe encargos económicos tanto à agricultura como à indústria de alimentos. Portanto, a maioria dos países estabeleceram regulamentações rigorosas para o nível máximo permitido de algumas micotoxinas nos alimentos.
Fungos que contaminam grãos, e outros produtos agrícolas, podem ser classificados em três grupos:
- fungos de campo;
- fungos intermediários;
- fungos de armazenamento.
Os fungos do campo são aqueles que requerem condições de alta umidade seja do ambiente ou nas regiões próximas às panículas, vagens ou espigas. Nas sementes, os fungos do campo causam redução do vigor e do poder germinativo.
Os fungos intermediários infectam o grão antes da colheita, mas, podem continuar causando perdas durante o armazenamento, quando o teor de água for mantido em torno de 20%. Um dos exemplos de fungos intermediários são os fungos do gênero Fusarium que tem a capacidade de infectar o milho antes da colheita, durante o armazenamento e mesmo na ração formulada.
Os fungos de armazenamento são aqueles que dispõem de capacidade de crescer em ambientes com baixas atividades de água dos grãos.
A palavra “Micotoxina” tem origem na palavra grega Mykes que significa fungo, e Toxicum que significa veneno ou toxina nocivas ao homem.
As micotoxinas são encontradas principalmente em produtos agrícolas, como cereais (arroz, trigo, soja, cevada, aveia), nozes, legumes, frutas secas, especiarias e produtos derivados, como farinha, flocos e cerveja. Fatores como alta temperatura, tecnologias de produção inadequadas e condições não estéreis de armazenamento das culturas contribuem para a contaminação dos commodities agrícolas por micotoxinas.
As micotoxinas podem ser classificadas como agudas ou crônicas. A toxicidade aguda ocorre rapidamente com uma resposta tóxica evidente, enquanto a toxicidade crônica mostra uma exposição a baixas doses por um longo período de tempo, resultando em efeitos irreversíveis. O maior risco das micotoxinas para humanos é geralmente consequência da exposição alimentar crônica.
Algumas micotoxinas, como aflatoxinas (AFs), ocratoxina A (OTA), fumonisinas (FMN), desoxinivalenol (DON), zearalenona (ZEN) e patulina, receberam atenção pública devido aos seus graves efeitos à saúde humana. Os seus impactos na rentabilidade agrícola estão associados à redução da qualidade das colheitas e à sua toxicidade nos seres humanos (efeitos hepatotóxicos, mutagênicos e teratogênicos).
Uma das preocupações mais significativas das micotoxinas é sua estrutura química diversificada e geralmente alta termoestabilidade. Portanto, dificilmente são eliminados dos alimentos por meios químicos (oxidação, redução, hidrólise, alcoólise e absorção), físicos (isolamento térmico, tratamento de radiação, plasma de baixa temperatura) e biológicos. Portanto, o tratamento inovador com uso de ozônio tem sido proposto no mercado para remover ou degradar micotoxinas em alimentos.
Ozônio na degradação de micotoxinas
O tratamento com ozônio na degradação de micotoxinas já foi comprovado cientificamente por diversos pesquisadores e empresas que comprovaram que o ozônio é capaz de promover modificações químicas em micotoxinas e reduzir a sua atividade.
Existem basicamente dois modos de inativação de micotoxinas pelo ozônio. Em primeiro lugar, grupos sulfidrila, aminoácidos de enzimas, peptídeos e proteínas oxidam para produzir peptídeos menores. Em segundo lugar, os ácidos graxos poli-insaturados que oxidam para produzir peróxidos ácidos. Essa interação resulta na perda de ligações duplas e modificação de estruturas moleculares, causando vazamento de seu conteúdo e, por fim, morte celular.
A eficiência do gás ozônio foi comprovada cientificamente na redução de 29, 45 e 32% de DON no farelo de trigo após 15, 30 e 240 min de exposição na concentração de 62 gm−3; 55, 57, 36 e 30% de Aflatoxina (B1, B2, G1 e G2) em grãos de milho após 480 min de exposição na concentração de 60 gm−3 e 38, 56 e 62% de ZEA na farinha de milho após 5, 10 e 60 minutos de exposição aplicando-se o gás na concentração de 52 gm−3. O estudo de Qi et al. (2016) indicaram que o tratamento com ozônio foi eficaz para a descontaminação ZEN e OTA de milho naturalmente contaminado.
É fundamental destacar que a eficiência do ozônio na degradação de micotoxinas depende da concentração do ozônio, método de tratamento (aquoso/gasoso), tempo de exposição, sensibilidade dos conídios fúngicos e propriedades do grão. Por exemplo, o ozônio é mais expressivo na degradação de AFB1 e AFG1.
A degradação da aflatoxina (AFB1 e AFG1) pelo ozônio começa com um ataque eletrofílico na ligação dupla C8-C9 do furano, que leva à formação de ozonídeos primários seguido de rearranjo em derivados de monóxido como aldeídos, cetonas e ácidos orgânicos. A via da ozonólise da AFB1 é apresentada na Fig. 1. Entretanto, a degradação de AFB2 e AFG2 requer maior tempo de exposição ao ozônio para garantir a abertura completa do anel de lactona.
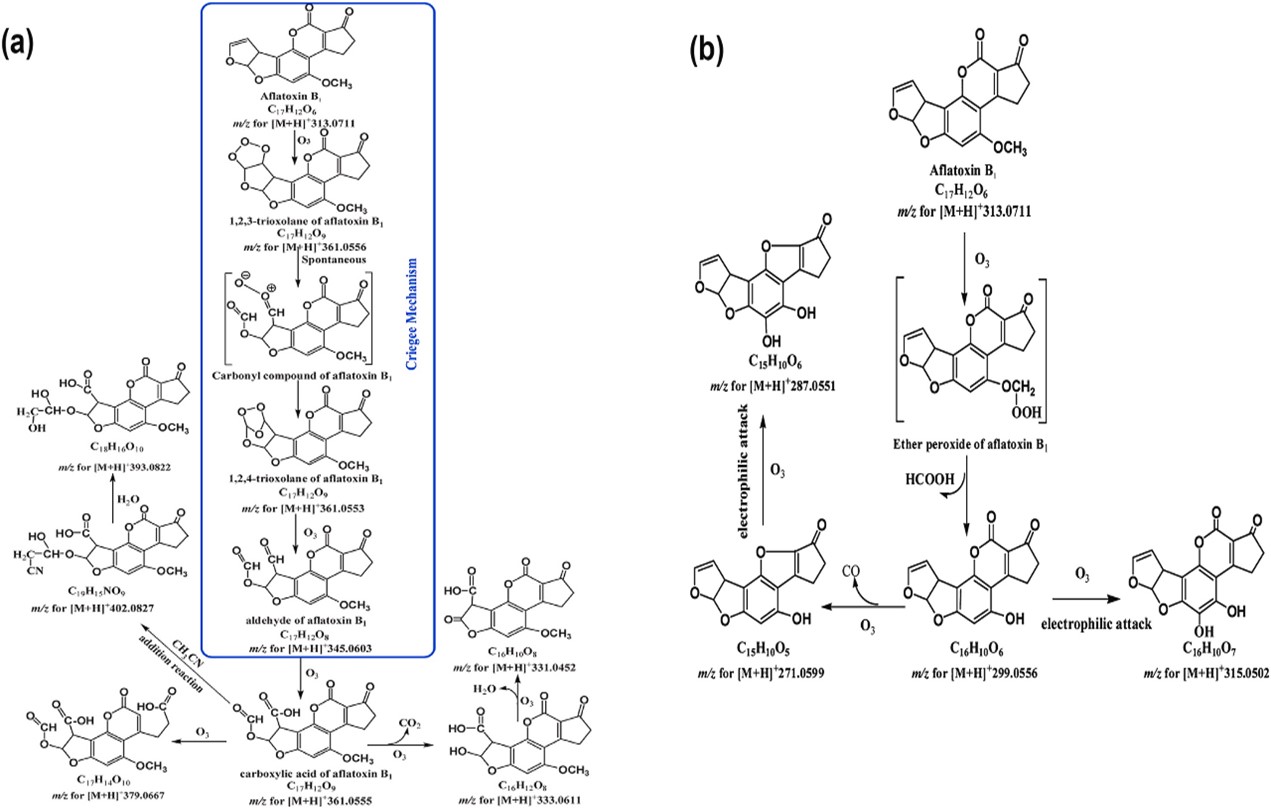
Figura 1. (a): Primeira via de ozonólise da aflatoxina B1 em solução de acetonitrila. (b): Segunda via de ozonólise da aflatoxina B1 em solução de acetonitrila.
Fonte: Mir et al. (2021)
Autor: Eugénio da Piedade Edmundo Sitoe PhD
Técnico em Agropecuária pelo Instituto Agrário de Chókwè (IACho) – Moçambique. Graduado em Engenharia Agrícola pelo Instituto Superior Politécnico de Gaza-ISPG – Moçambique. Mestre em Agroecologia pelo Instituto Superior Politécnico de Gaza – ISPG – Moçambique. Doutor e Pós-doc em Engenharia Agrícola, com ênfase em Engenharia de Processamento de Produtos Agrícolas pela UFV. É docente no Instituto Politécnico Santa Maria de Cenáculo – Moçambique; Colaborador a tempo parcial no Instituto Superior de Ciências e Educação a Distância- Moçambique; Funcionário Efetivo da Direção Provincial da Ciência e Tecnologia, Ensino Superior e Técnico Profissional – Moçambique. Trabalha em pesquisas voltadas para a área de armazenamento e processamento de produtos agrícolas. Dentre as pesquisas desenvolvidas estão voltadas para a aplicação de ozônio gasoso a baixa pressão para controle de insetos-praga e degradação de resíduos de agrotóxicos em grãos. Desde novembro de 2023 como Gerente de Pesquisa e Desenvolvimento da myOZONE® e coordena o grupo de especialistas do “Ozone Manager”.
Referências para este Artigo:
Alexandre, A. P., Castanha, N., Calori-Domingues, M. A., & Augusto, P. E. (2017). Ozonation of whole wheat flour and wet milling effluent: Degradation of deoxynivalenol (DON) and rheological properties. Journal of Environmental Science and Health, Part B, 52(7), 516-524.
Conte, G., Fontanelli, M., Galli, F., Cotrozzi, L., Pagni, L., & Pellegrini, E. (2020). Mycotoxins in feed and food and the role of ozone in their detoxification and degradation: An update. Toxins, 12(8), 486.
Mir, S. A., Dar, B. N., Shah, M. A., Sofi, S. A., Hamdani, A. M., Oliveira, C. A., … & Sant’Ana, A. S. (2021). Application of new technologies in decontamination of mycotoxins in cereal grains: Challenges, and perspectives. Food and Chemical Toxicology, 148, 111976.
Piemontese, L., Messia, M. C., Marconi, E., Falasca, L., Zivoli, R., Gambacorta, L., & Solfrizzo, M. (2018). Effect of gaseous ozone treatments on DON, microbial contaminants and technological parameters of wheat and semolina. Food Additives & Contaminants: Part A, 35(4), 761-772.
Qi, L., Li, Y., Luo, X., Wang, R., Zheng, R., Wang, L., … & Chen, Z. (2016). Detoxification of zearalenone and ochratoxin A by ozone and quality evaluation of ozonised corn. Food Additives & Contaminants: Part A, 33(11), 1700-1710.
Savi, G. D., Piacentini, K. C., Bittencourt, K. O., & Scussel, V. M. (2014). Ozone treatment efficiency on Fusarium graminearum and deoxynivalenol degradation and its effects on whole wheat grains (Triticum aestivum L.) quality and germination. Journal of Stored Products Research, 59, 245-253.
Sujayasree, O. J., Chaitanya, A. K., Bhoite, R., Pandiselvam, R., Kothakota, A., Gavahian, M., & Mousavi Khaneghah, A. (2022). Ozone: An advanced oxidation technology to enhance sustainable food consumption through mycotoxin degradation. Ozone: Science & Engineering, 44(1), 17-37.